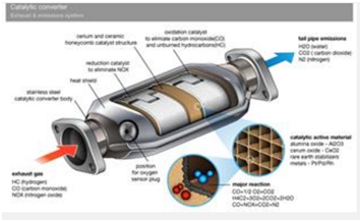
催化剂的催化原理是什么?
的有关信息介绍如下:催化的本质就是:在不同的催化剂上化学反应的速率不同。催化剂可以促进反应进行,也可以抑制反应进行。催化剂的三大性质:(1)催化活性(2)特定反应选择性(3)本身稳定性。如果你想讨论任何一个催化剂,这三大性质都是跑不掉的。全部讨论清楚了才算一个比较系统的工作。电子可以作为“反应物”,但这是电荷转移反应的内容了。具体理论可以看Marcus Theory。Oh, By the way,很多催化剂在经过几次“催化”之后就变得面目全非了(我们现在课题组正在研究这样的一种材料,希望搞清楚里面究竟发生了什么事情)。所以催化剂并不是“压根不变”的。而且如果反应中有一些毒化物种(例如CO等),那么它就会毒化催化剂的表面。在纳米粒子催化剂以及电催化剂当中,表面的重构屡见不鲜的。(不过在高中阶段,以课本为主)PS:本答案的初衷是希望你可以启发思路,有想法是好事情,但是要记住:科学是非常精密复杂的一个机器,要抱着敬仰的心态来对待。加油!要想弄清催化剂在催化反应中所起的作用(也就是你题目中的问题),以下几个基础必须得事先弄清楚:如何描述化学键/化学反应中的相互作用(van der Waals(范德华作用),静电作用,电场-偶极子耦合作用,etc.)如果想从数学、物理的角度来理解这件事请,你必须先学习量子力学、再学量子化学、最后学到固体物理、能带理论才能真正对其中的变化有所了解。将催化剂加入了反应体系之后,可能改变的有:反应路径相同反应的活化能。如果催化剂可以使得反应中的某一个活泼中间物稳定下来,那么整个反应就有可能向某一个方向进行(这就是催化剂可以提高化学反应的选择性的一个例子,感兴趣可以参考有机化学。因为有机化学中,高选择性、高产率是他们追求的目标。)如果催化剂可以使得基元反应的过渡态稳定,那么它可以使基元反应的活化能降低,从而提升反应的速率。